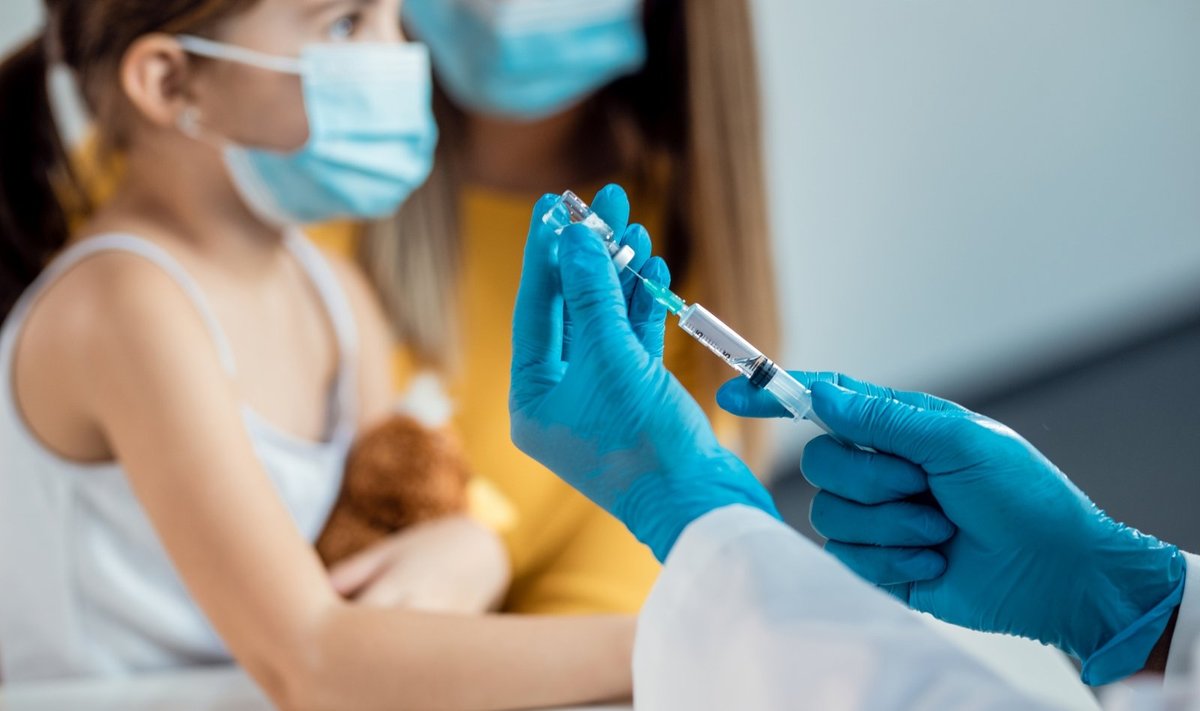
„ŽSVK rekomendacija leisti naudoti mūsų vakciną nuo COVID-19 6-11 metų amžiaus vaikams Europoje yra svarbus žingsnis, įrodantis mūsų vakcinos efektyvumą ir saugumą šiai svarbiai pacientų grupei, – kalbėjo Stéphane Bancel, „Moderna“ vyriausiasis vykdantysis direktorius. – Esame dėkingi ŽSVK, kad jis kruopščiai išnagrinėjo mūsų pateiktą informaciją, ir nekantriai laukiame, kad Europos Komisija paskelbtų savo leidimą.“
„Moderna“ vakcina buvo tiriama „KidCOVE“ 2/3 etapo tęstinių klinikinių tyrimų metu. Šie tyrimai yra atsitiktinių imčių, tyrėjui koduoti, placebu kontroliuojami išplėstiniai klinikiniai tyrimai, kuriais siekiama įvertinti sveikiems vaikams sušvirkštos „Spikevax“ (mRNR-1273) vakcinos saugumą, toleravimą, reaktogeniškumą ir efektyvumą 28 dienų laikotarpiu. ŽSVK pateikti daugiau nei 4 000 vaikų duomenys parodė, kad vaikų nuo 6 iki 12 metų skiepijimas 50 μg mRNR-1273 pirmine serija yra siejamas su lygiaverčiu SARS-CoV-2 neutralizuojančių antikūnų atsaku kaip ir 18-25 metų amžiaus asmenų grupėje, dalyvavusioje 3 etapo COVE klinikiniuose tyrimuose. Taip pat buvo įrodytas dviejų 50 μg dozių mRNR-1273 teigiamas tiesioginis efektyvumas, o ir patys skiepai buvo gerai toleruojami.
Klinikiniai tyrimai atlikti bendradarbiaujant su Nacionaliniu alerginių ir infekcinių ligų institutu (angl. The National Institute of Allergy and Infectious Diseases, NIAID), priklausančiu nacionaliniams sveikatos institutams, ir Biomedicinos pažangių tyrimų ir plėtros institucijai (angl. The Biomedical Advanced Research and Development Authority, BARDA), kuri savo ruožtu yra JAV Sveikatos ir žmonėms skirtų paslaugų departamento Parengties ir atsako sekretoriaus pavaduotojo tarnybos dalis. Unikalus JAV vyriausybės klinikiniams tyrimams suteiktas numeris yra NCT04796896.
EVA taip pat rekomendavo atnaujinti produkto charakteristikų santrauką, skirtą „Spikevax“ naudojimui Europos Sąjungoje. 18 metų ir vyresniems asmenims skirta stiprinančioji 50 µg dozė šiuo metu rekomenduojama ne anksčiau kaip po trijų mėnesių nuo antrosios dozės sušvirkštimo. Šis laikotarpis buvo sutrumpintas nuo anksčiau rekomenduotų šešių mėnesių. Pakeitimai taip pat apima galimybę paskirti ir kito gamintojo stiprinančiąją dozę, pavyzdžiui, „Spikevax“, užbaigus pirminės vakcinacijos schemą kita patvirtinta vakcina nuo COVID-19.
„Moderna“ neseniai paskelbė, kad Australijos terapinių prekių administracija taip pat suteikė laikiną registraciją bendrovės mRNR vakcinai nuo COVID-19, kuri yra skirta aktyviai 6-11 metų amžiaus vaikų imunizacijai siekiant užkirsti kelią SARS-CoV-2 sukeltai COVID-19 infekcijai.
Įgaliotas naudojimas
SPIKEVAX (elasomerano mRNR vakciną) buvo leista naudoti pagal Europos Komisijos suteiktą sąlyginį rinkodaros leidimą, remiantis Europos vaistų agentūros rekomendacija. Ji yra skirta aktyviai 6 metų ir vyresnių asmenų imunizacijai, kuria siekiama apsaugoti nuo susirgimo SARS-CoV-2 viruso sukeliamos koronaviruso ligos (COVID-19). Stiprinančioji dozė gali būti paskirta 18 metų ir vyresniems asmenims ne anksčiau kaip po trijų mėnesių nuo antrosios dozės sušvirkštimo.