Alchemikai nuo pat amžių glūdumos tikėjo, kad paprastus metalus galima paversti tauriaisiais – auksu ir sidabru. Ir nors alchemija yra laikoma chemijos bei medicinos prosenele, dauguma šios disciplinos „tiesų“ tik sukelia juoką. Visgi kalbėdami apie metalų transmutacijas alchemikai netyčia užčiuopė tiesos grūdą – po kelių šimtų metų fizikai, supratę atomų branduolių sandarą, numatė mechanizmą, leidžiantį vienus elementus paversti kitais. Tiesa, niekas nesako, kad užsiimti moderniąja alchemija įmanoma paprastoje laboratorijoje – tam reikia greitintuvų ir tokių energijos kiekių, kurie yra įmanomi išgauti tik žvaigždėse. Mokslininkai čia nesustojo – jie iš karto prikūrė tuzinus naujų cheminių elementų. Tiesa, tai nebuvo visai jau nauji elementai – mokslininkai sugebėjo susintetinti medžiagas, kurių mūsų planetoje negalime rasti dėl to, kad jos suiro prieš tūkstančius metų.
Atrodytų tokie grandioziniai atradimai, leidžiantys perprasti iš ko sudaryta viskas aplink mus (ir mes patys) bei praskleidžiantys uždangą į didžiąją pasaulio sukūrimo sceną. Tuo tarpu žmogus tiesiog ima ir pirmas darbas, kurį atlieka su šiomis žiniomis – sukuria iki šiol nematytą griovimo ir žudymo galią turinčią bombą. Lyg to būtų maža, apie penkiasdešimt metų šis „ginklas“ aktyviai tobulinamas ir didinami jo kiekiai, taip visai žmonijai įvarant didžiulę paranoją. Ir tik vėliau, lyg tarp kitko, „atomas“ panaudojamas taikiems tikslams – deja, baimės jausmas lydi ir čia. Černobylio ir Fukušimos tragedijos, Rusijos, Š. Korėjos ir Irano branduolinio ginklo grėsmė – mes vis dar nervingai dairomės per petį, išgirdę žodį „atominis“. Paradoksalu, kad Nobelio premijos, suteiktos mokslininkams už pasiekimus tiriant atomo branduolį, davė pagrindą septynioms Nobelio taikos premijoms, kuriomis buvo apdovanoti žmonės, įvairiais būdais stabdę branduolinio apsiginklavimo varžybas. Tačiau nėra tas velnias toks baisus, kaip jį piešia – pažiūrėkime, kas yra tas atomo branduolys ir kaip žodis „branduolinis“ įgavo savo neigiamą prasmę.
Iš ko aš sudarytas?
Atsakymas paprastas – iš atomų. Iš šių dalelių yra sudaryta viskas – žmonės, medžiai, bakterijos, ląstelės, planetos, žvaigždės ir t.t. Skirtingi atomai jungiasi į grupeles – molekules. Pavyzdžiui, vanduo yra sudarytas iš trijų – dviejų vandenilio ir vieno deguonies atomų. Gamtoje randami 92 skirtingi atomų tipai – kitaip vadinami cheminiais elementais, surašyti periodinėje Mendelejevo lentelėje, šalia kurių yra nemažas būrelis žmogaus sukurtų elementų. Tad kuo gi skiriasi šie atomai?
Pažvelgę giliau į atomą, pamatysime, kad jis sudarytas iš dar mažesnių (subatominių) dalelių: protonų, neutronų ir elektronų. Protonai ir neutronai laikosi kartu ir sudaro atomo branduolį, o elektronai sukasi aplink jį tarsi mėnulis aplink planetą. Protonai turi teigiamą krūvį, o elektronai – neigiamą, todėl vieni kitus traukia. Užtat teigiamą krūvį turintys protonai vienas kitą stumia ir branduolyje neišbūtų nė sekundės, jei ne juos rišantys „klijai“ – jokio krūvio neturintys neutronai. Atomuose dažniausiai yra po lygiai protonų ir elektronų, tad bendras atomo krūvis yra neutralus.
Protonų skaičius branduolyje nusako, kokio tipo tai atomas – kitaip tariant, koks tai elementas. Tarkime, jei paimsime trylika protonų ir keturiolika neutronų ir suklijuosime į vieną branduolį, o aplink paleisime suktis trylika elektronų – gausime aliuminio atomą. Koks aliuminio numeris Mendelejevo lentelėje? Tryliktas. Elemento numeris šioje lentelėje nurodo, kiek protonų yra jo branduolyje ir kiek elektronų įprastai sukasi aplink jį. Viskas būtų labai paprasta, bet čia atėjo neutronas ir sugadino tokią gražią simetriją.
Dėmesio – radiacija!
Neutronų skaičius branduolyje gali skirtis nuo protonų skaičiaus. Pavyzdžiui, vario atomas gali įgauti dvi formas, kuriose protonų skaičius toks pats (29), o neutronų skaičius skiriasi – tokie atomai „pusbroliai“ vadinami izotopais. Du trečdalius viso pasaulyje randamo vario sudaro varis-63, turintis 34 neutronus ir vieną trečdalį sudaro varis-65, turintis 36 neutronus. Abu vario izotopai atrodo ir elgiasi vienodai, tačiau ši taisyklė negalioja daugeliui kitų elementų.
Kai kurių elementų branduoliai tiesiog negali pakęsti didesnio neutronų skaičiaus ir ta „neapykanta“ sukelia radikalių veiksmą – skilimą. Pavyzdžiui, vandenilio izotopas tritis turi vieną protoną ir du neutronus ir tai nepakenčiama, todėl ilgainiui jis virsta kitu elementu – heliu-3, turinčiu du protonus ir vieną neutroną. Šis procesas vadinamas radioaktyviu skilimu, o jo metu išsiskiria visus taip bauginanti radiacija, skirstoma į keturias rūšis: alfa, beta, gama ir neutronų spinduliai. Šios radiacijos rūšys yra skirtingos skvarbos ir energijos, tad skirtingai sąveikauja su kitais atomais – ir yra ypač žalinga, jei tie atomai sudaro gyvų organizmų ląsteles.
Kai kurie elementai turi tik vieną ar kelis radioaktyvius elementus, o kiti ir patys yra radioaktyvūs, ir visi jų izotopai yra tokie pat. Vienas tokių elementų yra uranas – sunkiausias gamtoje randamas radioaktyvus elementas, nuo kurio ir prasidėjo visas branduolinis kipišas.

1896 metais Henri Becquerelis pastebėjo, kad šalia uranito (sudaryto iš urano ir radžio) gabalėlio padėta fotografinė plokštelė per tam tikrą laiką patamsėdavo. Vėliau jis nustatė, kad šį efektą sukeldavo alfa (helio branduolių) ir beta (elektronų) dalelių spinduliavimas, sklindantis iš uranito. Tais pačiais metais Pierre'as ir Marie Curie pradėjo tyrinėti šį fenomeną ir davė jam pavadinimą – radioaktyvumas. Dar po dviejų metų iš uranito jie išskyrė du radioaktyvius elementus – polonį ir radį. Pastarasis iki šiol naudojamas vėžio gydymo procese, o poloniu prieš aštuonis metus KGB agentai mirtinai apnuodijo prieglobsčio D. Britanijoje ieškojusį buvusį savo kolegą Aleksandrą Litvinenko.
Panašiu metu Ernestas Rutherfordas ir Paulas Villardas savo eksperimentuose pastebėjo trečią radiacijos rūšį – gama spindulius, daug skvarbesnius nei alfa ir beta dalelės, kurias sustabdo popieriaus ar metalo folijos lakštas. Gama spinduliams sustabdyti reikia gero gabalo švino. 1902 metais E. Rutherfordas suprato, kad vykstant spontaniškam radioaktyvių elementų skilimui, susidaro nauji cheminiai elementai.
Svarbu suprasti, kad visi šie mokslininkai tyrinėjo radiaciją, kaip spontanišką procesą, būdingą tik tam tikriems cheminiams elementams. Tuo tarpu 1919 metais E. Rutherfordas alfa dalelėmis apšaudė azoto atomus ir pastebėjo, kad gavo deguonį. Taip prasidėjo nauja moderniosios „alchemijos“ era.
„Velniškoji“ dalelė
E. Rutherfordas atliko didžiulį darbą pats tirdamas radioaktyvumą bei atomų branduolius, už ką gavo 1908-aisiais gavo Nobelio chemijos premiją. Jam turime būti dėkingi ne tik už jo atradimus, bet ir už mokslui įkvėptus jaunus mokslininkus, kurie savo ruožtu atliko grandioziškus atradimus ir buvo apdovanoti vėlesnėmis Nobelio premijomis.
Vienas jų buvo nuo pat magistro studijų kartu su E. Rutherfordu dirbęs Jamesas Chadwickas. 1932 metais jis pastebėjo, kad branduolyje be protonų yra ir kitų dalelių, neturinčių krūvio, todėl jas pavadino neutronais. Šios dalelės iš karto įkvėpė kitus mokslininkus naujiems eksperimentams. Juk neutronai daug patogesni atomų branduoliams apšaudyti – jie neturi krūvio, todėl atomuose esantys protonai jų neatstumia. Ši idėja kaipmat užkariavo kitų dviejų E. Rutherfordo mokinių – Johno Cockcrofto ir Ernesto Waltono – galvas. Tais pačiais metais jie apšaudė ličio atomus didelės energijos neutronais, elektronais ir protonais – taip paversdami litį heliu bei kitais cheminiais elementais. Galiausiai žymusis Enrico Fermi 1935 metais eksperimentais parodė, kad apšaudant atomų branduolius neutronais, galima gauti begalę naujų elementų ir jų izotopų, dažniausiai radioaktyvių. Be to, E. Fermi parodė, kad sulėtinus neutronus parafinu, jie turi daugiau laiko „pabendrauti“ su apšaudomais atomais ir taip efektyviau juos pakeičia.
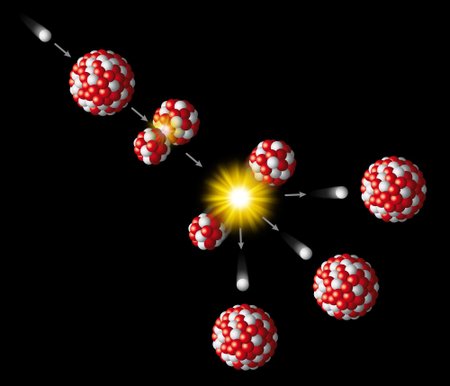
Neilgai truko, kol mokslininkai suprato, kad papildomai išspinduliuojami neutronai suskaldo kitus urano atomus, o šios reakcijos metu atsiranda dar daugiau neutronų ir taip toliau – prasideda grandininė reakcija. Šis procesas ir tapo pagrindu branduoliniam ginklui bei atominėms elektrinėms sukurti.
J. Chadwicko bei E. Fermi tyrimai buvo tokie svarbūs ir ryškūs, kad Nobelio premijos jiems buvo suteiktos praėjus vos trejiems metams po atradimo fakto. 1935 metais J. Chadwickas apdovanotas Nobelio fizikos premija „už neutrono atradimą“, o E. Fermi pagerbtas 1938 metais „už naujų radioaktyvių elementų, gautų neutronų švitinimu, egzistavimo demonstravimą ir už branduolinių reakcijų, sukeltų lėtais neutronais, atradimą.“ Praėjus šešiems metams nuo O. Hahno eksperimentų jis gavo Nobelio apdovanojimą chemijos srityje „už sunkiųjų atomų branduolių skilimo atradimą.“ Tik J. Cockcroftas ir E. Waltonas savo premijos turėjo palaukti kiek ilgiau – „už novatorišką darbą atomų virsmuose, sukeltuose dirbtinai pagreitintomis dalelėmis“ Nobelio premiją jie gavo 1951-aisiais.
Tad kodėl neutronas yra „velniškoji“ dalelė? Prisiminkime, kad praeitais metais fizikos Nobelio premija įteikta dviem mokslininkams Peteriui Higgsui bei François Englertui už tai, kad jie savo teoriniuose skaičiavimuose numatė Higso bozono egzistavimą, kurį patvirtino Didžiojo hadronų greitintuve atlikti eksperimentai. Higso bozonas leidžia paaiškinti, kodėl kai kurios subatominės dalelės turi masę ir kodėl egzistuoja materija, iš kurios sudaryti esame ir mes visi – dėl to fizikas Leonas Ledermanas Higso bozona savo knygoje pavadino „dieviškąja dalele“.

Tuo tarpu pirmas komercinis branduolinis reaktorius elektros energijai gaminti paleistas tik 1960-aisiais – jame taip pat neutronais skaldomas uranas, tik ši reakcija kontroliuojama. Išsiskyręs karštis naudojamas vandeniui šildyti, o susidarę garai suka turbinas, generuojančias elektros energiją. O ši ateina pas mus laidais ir maitina kompiuterį, kuriame skaitote šį straipsnį. Atomas – artimas, nes yra kiekviename iš mūsų, ir tuo pačiu toks tolimas, nes pradėjus su juo neatsargiai žaisti, galima stipriai nudegti.
